手把手教你,流式实体组织样本制备
|
流式细胞术包含几个重要环节,包括:①单细胞悬液样品的制备、②选择合适的抗体并染色、③上机操作、④数据分析。每个步骤都很重要,直接决定了是否能获得满意的流式结果。 动物组织制备单细胞悬液时,有的使用了消化液方案,有的并不需要,视组织分离难易而定,本文介绍小鼠脾脏无消化液方案制备单细胞悬液。 图片 1. 取材:安乐死小鼠并取出脾脏,将脾脏放入培养皿中,并加入1mLPBS缓冲液。 注意: 1)流式一般要求染色前为活细胞(部分染色需要破膜、固定操作,此时细胞就变成死细胞了),因此取出的动物组织不可放入液氮中。 2) 带有少量脂肪组织问题不大,因为脂肪组织不好研磨,后续会通过细胞筛将其过滤掉。 3) 取材前不需要血液灌流,因为后续有裂红步骤。
2. 研磨:用无菌注射器柄轻轻研磨组织。
3. 吹散、过滤细胞:额外加入约 5mL PBS 缓冲液至培养皿中,轻轻吹散细胞,随后用70um细胞筛进行过滤。 4. 离心:常温离心弃上清获得细胞团。离心参数:300g,5min。
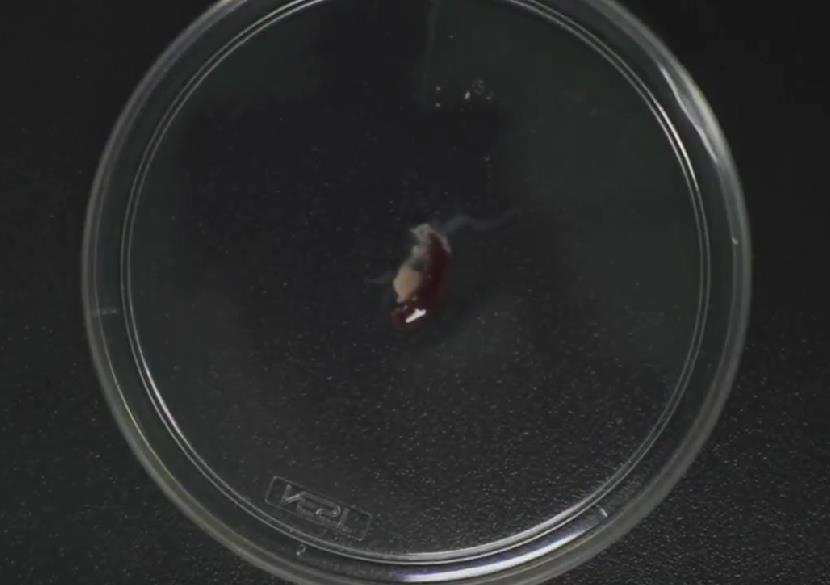
5.裂红:加入1X红细胞裂解液2mL重悬(若为10X裂解液,则需要现配现用稀释至1X)。常温裂解2min,2min后加入6-8mL PBS终止裂解。
▲图为裂红后呈现的淡红色浑浊液 6.离心弃裂红液,保留底部细胞团,离心参数同上:300g,5min。
7. 重悬获得单细胞悬液:用2~3mL PBS 或细胞染色缓冲液(Cell Staining Buffer )重悬为单细胞悬液。
8. 细胞计数:此前步骤已将单细胞悬液制备完成,要求严格的,特别是初次实验时,还需要进行细胞计数。控制细胞数量在 1x10^7 / mL 为宜,这样取 100μL 样本时,细胞总数便达到 1x10^6 了。 ▲图片来源网络
9. 避光、分管染色:按实验要求分管染色,每管一般取 100μL 单细胞悬液进行染色。
|








 微信公众号下单更便捷
微信公众号下单更便捷